Calcium chloride : कैल्शियम क्लोराइड का उपयोग और बनाने की विधि :- आज हम इस लेख में Calcium chloride के बारे में जानकारी दे रहे है। कैल्शियम क्लोराइड क्या है ?, कैल्शियम क्लोराइड का उपयोग, कैल्शियम क्लोराइड बनाने की विधि ,कैल्शियम क्लोराइड की संरचना, कैल्शियम क्लोराइड का रासायनिक सूत्र, कैल्शियम क्लोराइड का अणुभार कैल्शियम क्लोराइड के विलयन और कैल्शियम क्लोराइड के भौतिक व रासायनिक गुण के बारे में जानकारी दे रहे है। आपको यह लेख अंत तक पढ़ना है और इससे सम्बंधित सवालो के लिए कमेंट करना है।
वीं शताब्दी में Calcium chloride की खोज की गई थी। लेकिन 18 वीं शताब्दी के उत्तरार्ध तक इस पर बहुत कम अध्ययन किया गया था। प्रारंभिक सभी कार्य प्रयोगशाला में तैयार नमूनों के साथ किए गए थे, क्योंकि सोडा ऐश के निर्माण के लिए अमोनिया-सोडा प्रक्रिया के संचालन में होने तक इसका व्यावसायिक पैमाने पर उत्पादन नहीं किया गया था। जब तक इसके उपयोग की खोज नहीं की गई थी, तब यह एक बेकार उत्पाद माना जाता था।
Calcium chloride दुर्लभ वाष्पीकरणीय खनिज सिंजाराइट (डाईहाइड्रेट) और अंटार्कटिकासाइट (हेक्साहाइड्रेट) के रूप में होता है। इसका एक अन्य प्राकृतिक हाइड्रेट ज्ञात है घियाराइट (एक टेट्राहाइड्रेट)। संबंधित खनिज क्लोरोकैल्साइट (पोटेशियम कैल्शियम क्लोराइड, KCaCl3) और टैचीहाइड्राइट (कैल्शियम मैग्नीशियम क्लोराइड, Ca Mg2Cl6·12H2O) भी बहुत दुर्लभ हैं। इसीलिए यह रोरीसाइट CaClF (कैल्शियम क्लोराइड फ्लोराइड) के लिए सच है।
कैल्शियम क्लोराइड क्या है?-Calcium chloride
कैल्शियम क्लोराइड एक अकार्बनिक यौगिक है, जिसका रासायनिक सूत्र CaCl2 होता है। इसका अणुभार 110.98 ग्राम/मोल होता है। यह कमरे के तापमान पर सफेद रंग का क्रिस्टलीय ठोस पदार्थ होता है और यह पानी में अत्यधिक घुलनशील होता है। यह कैल्शियम हाइड्रोक्साइड और हाइड्रोक्लोरिक एसिड की अभिक्रिया से बनाया जा सकता है। इसमें विलयन का बहुत अधिक एन्थैल्पी परिवर्तन होता है।
कैल्शियम क्लोराइड आमतौर पर सामान्य सूत्र CaCl2(H2O)x के साथ हाइड्रेटेड ठोस के रूप में पाया जाता है, जहां x = 0,1, 2, 4, और 6 होता है। इन यौगिकों का उपयोग मुख्य रूप से डी-आइसिंग और धूल नियंत्रण के लिए किया जाता है। क्योंकि निर्जल लवण हीड्रोस्कोपिक होता है। इसका उपयोग desiccant के रूप में भी किया जाता है।
कैल्शियम क्लोराइड का रासायनिक सूत्र, अणुभार
कैल्शियम क्लोराइड का रासायनिक सूत्र CaCl2 होता है। कैल्शियम क्लोराइड का अणुभार 110.98 ग्राम/मोल होता है।
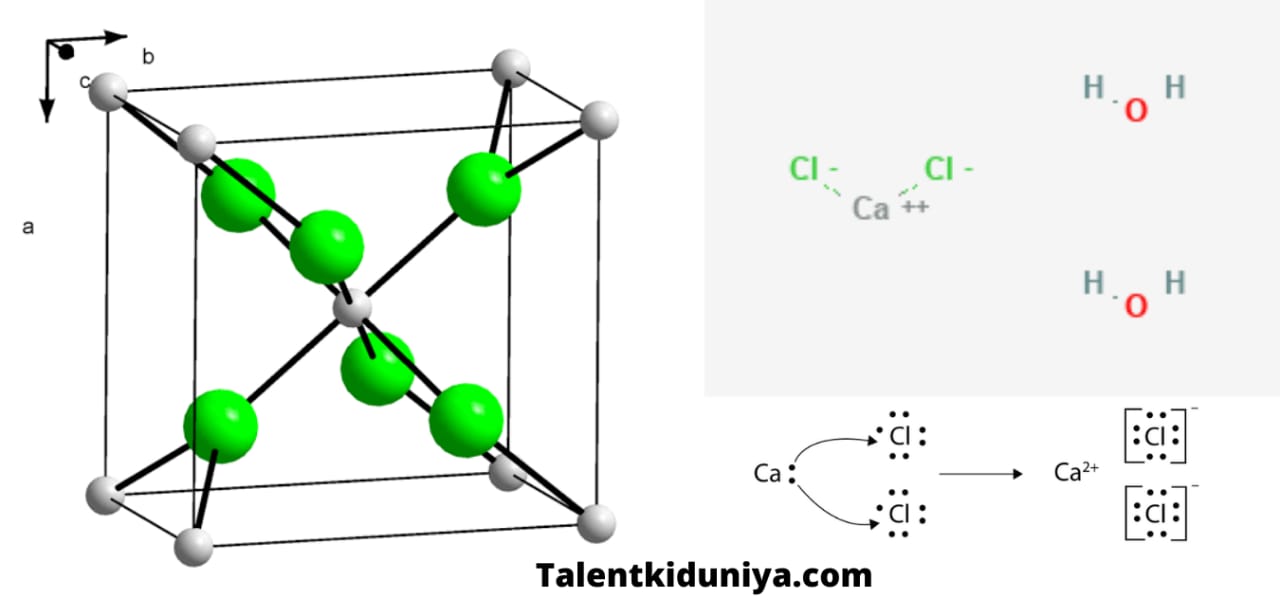
कैल्शियम क्लोराइड की संरचना-Calcium chloride
कैल्शियम क्लोराइड के अणुओं में एकल कैल्शियम धनायन और दो क्लोराइड आयनों के बीच दो आयनिक बंधन होते हैं। कैल्शियम धनायन +2 परिमाण का आवेश रखता है और प्रत्येक क्लोराइड आयन -1 परिमाण का आवेश रखता है। इसीलिए यह एक आयनिक योगिक है। कैल्शियम क्लोराइड
अणु की क्रिस्टल की संरचना ओर्थोरोम्बिक (rutile, anhydrous के लिए क्रिस्टल की संरचना), चतुष्कोणीय (anhydrous, > 217 °C ताप से ऊपर क्रिस्टल की संरचना) और त्रिकोणीय संरचना (hexahydrate क्रिस्टल की संरचना ) होती है।
कैल्शियम क्लोराइड का विलयन-Calcium chloride
कैल्शियम क्लोराइड जल में अत्यधिक घुलनशील होता है। इसकी उच्च घुलनशीलता के कारण इसका उपयोग अपेक्षाकृत उच्च घनत्व वाले विलयन प्राप्त करने के लिए किया जाता है। जैसे 1430kg/m3 जितना उच्च घनत्व 208°C पर और 1570kg/m3 808°C पर प्राप्त किया जाता है। तेल और गैस ड्रिलिंग उद्योग कुओं को पूरा करने या फिर से काम करने के दौरान अक्सर इन उच्च घनत्व का फायदा उठाते हैं। घनत्व या विशिष्ट गुरुत्व का उपयोग जल में कैल्शियम क्लोराइड की मोलल सांद्रता c को निर्धारित करने के लिए भी किया जा सकता है।
विभिन्न मूल्यों और विभिन्न तापमानों पर कैल्शियम क्लोराइड के विलयन के घनत्व की पहचान की गई है। 323K से 600K के तापमान पर और 40MPa तक के दाब पर कैल्शियम क्लोराइड विलयनों का घनत्व और स्पष्ट दाढ़ की मात्रा भी बताई गई है। विस्कोसिटी (Viscosity) इंजीनियरिंग डिजाइन के संदर्भ में और छिद्रयुक्त मीडिया के माध्यम से प्रवाह करने के लिए ऐसे विलयनों के उपयोग में कैल्शियम क्लोराइड विलयनों का एक महत्वपूर्ण गुण है।
1980 के दशक में कैल्शियम क्लोराइड विलयन की उष्मागतिकी पर कई अध्ययन प्रकाशित किए गए थे। इनमें से कई उच्च आयनिक क्षमता के इलेक्ट्रोलाइट विलयनों में गतिविधि गुणांक और अन्य मापदंडों के निर्धारण के लिए पित्जर समीकरणों के सत्यापन और विस्तार की ओर उन्मुख थे। कैल्शियम क्लोराइड कई प्रक्रियाओं का उपयोग करके व्यावसायिक मात्रा में उत्पादित किया जाता है।
कैल्शियम क्लोराइड के भौतिक व रासायनिक गुण
- यह एक अकार्बनिक सफेद रंग का क्रिस्टलीय ठोस पदार्थ होता है।
- यह जल में घुलनशील होता है। इसके अलावा यह एसिटिक एसिड, एल्कोहल, एथेनॉल, मेथनॉल, एसीटोन, pyridine में भी घुलनशील होता है। जबकि NH3, DMSO, CH3COOC2H5 में अघुलनशील होता है।
- इसका रासायनिक सूत्र CaCl2 होता है।
- इसका आण्विक द्रव्यमान 110.98 ग्राम/मोल होता है।
- इसका गलनांक 772-775 °C anhydrous अणु के लिए, 260 °C monohydrate अणु के लिए, 175 °C dihydrate अणु के लिए, 45.5 °C tetrahydrate अणु के लिए, 30 °C hexahydrate अणु के लिए होता है।
- इसका क्वथनांक 1935 °C anhydrous अणु के लिए होता है।
- इसके anhydrous अणु की क्रिस्टल संरचना ओर्थोरोम्बिक होती है।
- कैल्शियम क्लोराइड जल में घुलनशील होता है, जिससे क्लोराइड और एक्वा कॉम्प्लेक्स [Ca(H2O)6]2+ प्राप्त होता है। इस प्रकार यह विलयन मुक्त कैल्शियम और मुक्त क्लोराइड आयनों का स्रोत हैं। यह विवरण इस तथ्य से स्पष्ट होता है कि यह विलयन फॉस्फेट स्रोतों के साथ अभिक्रिया करके कैल्शियम फॉस्फेट का एक ठोस अवक्षेप देता है। 3CaCl2 + 2PO3−4 → Ca3(PO4)2 + 6 Cl−
- पिघला हुआ कैल्शियम क्लोराइड कैल्शियम धातु और क्लोरीन गैस देने के लिए इलेक्ट्रोलाइज्ड किया जा सकता है। CaCl2 → Ca + Cl2
कैल्शियम क्लोराइड बनाने की विधि-Calcium chloride
- अधिकांशतः कैल्शियम क्लोराइड चूना पत्थर से सॉल्वे प्रक्रिया के उप-उत्पाद के रूप में प्राप्त होता है। सॉल्वे प्रक्रिया में चूना पत्थर से कैल्शियम क्लोराइड प्राप्त करने की अभिक्रिया इस प्रकार है।
2NaCl + CaCO3 → Na2CO3 + CaCl2
- प्रयोगशाला में कैल्शियम हाइड्रोक्साइड और हाइड्रोक्लोरिक एसिड की अभिक्रिया से भी कैल्शियम क्लोराइड बनाया जा सकता है।
Ca(OH)2 + HCl → CaCl2 + H2O
- अमेरिका में अधिकांश कैल्शियम क्लोराइड खारे जल से शुद्धिकरण द्वारा प्राप्त किया जाता है।
कैल्शियम क्लोराइड का उपयोग-Calcium chloride’s uses
डी–आइसिंग और हिमांक–बिंदु में
जल के हिमांक को कम करके कैल्शियम क्लोराइड का उपयोग बर्फ के निर्माण को रोकने के लिए किया जाता है और इसका उपयोग बर्फ को हटाने के लिए किया जाता है। यह उपयोग कैल्शियम क्लोराइड की सबसे बड़ी मात्रा को खपत करता है। कैल्शियम क्लोराइड पौधों और मिट्टी के लिए अपेक्षाकृत हानिरहित है।
एक डिसिंग एजेंट के रूप में यह सोडियम क्लोराइड की तुलना में कम तापमान पर अधिक प्रभावी होता है। जब इसे उपयोग के लिए वितरित किया जाता है, तो यह कुछ mm व्यास वाले छोटे, सफेद गोले का रूप ले लेता है। जिन्हें प्रिल्स कहा जाता है। कैल्शियम क्लोराइड के विलयन −52 °C तापमान पर ठंड को रोक सकते हैं।
रोड सरफेसिंग में (in Road surfacing)
कैल्शियम क्लोराइड का दूसरा सबसे बड़ा उपयोग इसकी हीड्रोस्कोपिक प्रकृति और इसके हाइड्रेट्स की चिपचिपाहट के कारण है। कैल्शियम क्लोराइड अत्यधिक हीड्रोस्कोपिक होता है। इसका जलयोजन एक एक्ज़ोथिर्मिक प्रतिक्रिया है। एक सांद्र विलयन गन्दी सड़कों की सतह पर एक तरल परत बनता है, जो धूल के निर्माण को दबा देता है।
यह महीन धूल के कणों को सड़क पर रखता है, जिससे एक कुशनिंग परत मिलती है। यदि इन्हें उड़ने दिया जाता है, तो बड़ा समूह इधर-उधर खिसकने लगता है और सड़क टूट जाती है। कैल्शियम क्लोराइड का उपयोग करने से ग्रेडिंग की आवश्यकता 50% तक कम हो जाती है और भरने वाली सामग्री की आवश्यकता 80% तक कम हो जाती है।
शुष्क एजेंट के रूप में-Calcium chloride
सुखाने वाली नलियों को अक्सर कैल्शियम क्लोराइड से भरा जाता है। केल्प को सोडियम कार्बोनेट के उत्पादन के लिए कैल्शियम क्लोराइड के साथ सुखाया जाता है। निर्जल कैल्शियम क्लोराइड का सूखापन सुनिश्चित करने के लिए एक पैकेजिंग सहायता के रूप में FDA द्वारा स्वीकृत किया गया है। हाइड्रेटेड लवण को पुन: उपयोग के लिए सुखाया जा सकता है, लेकिन अगर जल्दी से गर्म किया जाता है तो यह जलयोजन के अपने जल में घुल जाएगा और ठंडा होने पर एक कठोर एकीकृत ठोस बन जाएगा।
खाद्य पदार्थ में (in Food)
समुद्री एक्वैरियम में कैल्शियम क्लोराइड कैल्शियम कार्बोनेट-खोल वाले जानवरों जैसे मोलस्क और कुछ निडारियंस के लिए जैव उपलब्ध कैल्शियम को पेश करने का एक तरीका है। कैल्शियम हाइड्रॉक्साइड या कैल्शियम रिएक्टर का भी उपयोग किया जा सकता है। एक फर्मिंग एजेंट के रूप में कैल्शियम क्लोराइड का उपयोग डिब्बाबंद सब्जियों में, सोयाबीन दही को टोफू में गाड़ा करने और सब्जी या फलों के रस से कैवियार विकल्प (caviar substitute) बनाने में किया जाता है।
यह बोतलबंद पानी सहित स्पोर्ट्स ड्रिंक और अन्य पेय पदार्थों में इलेक्ट्रोलाइट के रूप में उपयोग किया जाता है। कैल्शियम क्लोराइड का अत्यंत नमकीन स्वाद भोजन की सोडियम सामग्री को बढ़ाए बिना अचार बनाने के लिए उपयोग किया जाता है। caramel से भरे चॉकलेट बार में कारमेल की ठंड को धीमा करने के लिए कैल्शियम क्लोराइड के हिमांक-बिंदु के अवसाद गुणों का उपयोग किया जाता है।
बियर बनाने में कैल्शियम क्लोराइड का उपयोग कभी-कभी शराब बनाने वाले पानी में खनिज की कमी को ठीक करने के लिए किया जाता है। यह पकने की प्रक्रिया के दौरान स्वाद और रासायनिक प्रतिक्रियाओं को प्रभावित करता है और किण्वन के दौरान खमीर के कार्य को भी प्रभावित कर सकता है। देर से उगने वाले मौसम के दौरान पेड़ पर छिड़काव करके सेब पर कॉर्क स्पॉट और कड़वे गड्ढे को रोकने के लिए कैल्शियम क्लोराइड का उपयोग किया जाता है।
अन्य उपयोग- Other uses of Calcium chloride
- प्रारंभिक सेटिंग में तेजी लाने के लिए कैल्शियम क्लोराइड का उपयोग कंक्रीट के मिश्रण में किया जाता है, लेकिन क्लोराइड आयनों से स्टील की छड़ का क्षरण होता है। इसलिए इसका प्रबलित कंक्रीट में उपयोग नहीं करना चाहिए। इस उद्देश्य के लिए कैल्शियम क्लोराइड के निर्जल रूप का भी उपयोग किया जा सकता है, जो कंक्रीट में नमी का एक माप प्रदान कर सकता है।
- कैल्शियम क्लोराइड के एक्ज़ोथिर्मिक विघटन का उपयोग सेल्फ-हीटिंग कैन और हीटिंग पैड में किया जाता है।
- इसका उपयोग घरेलू और औद्योगिक रासायनिक वायु dehumidifiers में भी किया जाता है।
- तेल उद्योग में कैल्शियम क्लोराइड का उपयोग ठोस मुक्त ब्राइन के घनत्व को बढ़ाने के लिए किया जाता है। इसका उपयोग उल्टे इमल्शन ड्रिलिंग तरल पदार्थ के जल के चरण में सूजन वाली मिट्टी (swelling clays) को रोकने के लिए भी किया जाता है।
- कैल्शियम क्लोराइड का उपयोग प्लास्टिक और आग बुझाने वाले यंत्रों में, व ब्लास्ट फर्नेस में मचान को नियंत्रित करने के लिए एक योजक के रूप में किया जाता है।
- कैल्शियम क्लोराइड का उपयोग सक्रिय चारकोल के उत्पादन में भी किया जाता है।
- कैल्शियम क्लोराइड का उपयोग पानी से फ्लोराइड आयनों को अघुलनशील CaF2 के रूप में अवक्षेपित करने के लिए किया जा सकता है।
- CaCl2 पिघले हुए NaCl के इलेक्ट्रोलिसिस के माध्यम से सोडियम धातु के औद्योगिक उत्पादन के लिए डेवी प्रक्रिया में गलनांक को कम करते हुए फ्लक्स सामग्री के रूप में कार्य करता है।
- इसी तरह टाइटेनियम उत्पादन के लिए FFC कैम्ब्रिज प्रक्रिया में CaCl2 का उपयोग फ्लक्स और इलेक्ट्रोलाइट के रूप में किया जाता है। जहाँ यह इलेक्ट्रोड के बीच कैल्शियम और ऑक्सीजन आयनों के उचित आदान-प्रदान को सुनिश्चित करता है।
- कैल्शियम क्लोराइड सिरेमिक स्लिपवेयर (ceramic slipware) में उपयोग किया जाने वाला एक घटक है। यह मिट्टी के कणों को निलंबित कर देता है ताकि वे विलयन के अंदर तैरते रहें। जिससे विभिन्न प्रकार की स्लिपकास्टिंग तकनीकों में उपयोग करना आसान हो जाता है।
- एथेनॉल (95 % ABV) में घुलने वाले डाइहाइड्रेट कैल्शियम क्लोराइड (20 % by weight) का उपयोग नर पशुओं के लिए स्टरलैंट (sterilant) के रूप में किया गया है। विलयन को जानवर के वृषण में इंजेक्ट किया जाता है। एक महीने के भीतर वृषण ऊतक के परिगलन के कारण नसबंदी हो जाती है।
सुरक्षा
यह यौगिक हानि पहुँचा सकता है, इसीलिए इसे दस्ताने के साथ संभालने की जरूरत है। इसे संभालना अपेक्षाकृत सुरक्षित है। लेकिन यदि इसे निगला जाता है, तो यह जल के साथ ऊष्माक्षेपी रूप से प्रतिक्रिया करता है और मुंह या आंत में जलन पैदा कर सकता है। तीव्र हाइपरकेलेमिया, हाइपरमैग्नेसीमिया और कैल्शियम-चैनल ब्लॉकर ओवरडोज के उपचार के लिए कैल्शियम क्लोराइड की भी सिफारिश की जाती है।
यह गीला होने पर कम मात्रा में गैर विषैले, गैर-हाइड्रेटेड लवण के अत्यधिक हीड्रोस्कोपिक गुण कुछ नुकसान दिखाते हैं। यह नम त्वचा को सुखाकर एक अड़चन के रूप में कार्य कर सकता है। ठोस कैल्शियम क्लोराइड एक्ज़ोथिर्मिक रूप से घुल जाता है और जलने पर मुंह और आंतो को नुकसान पहुँचा सकता है। सांद्र विलयन या ठोस उत्पादों के अंतर्ग्रहण से जठरांत्र संबंधी जलन या अल्सर हो सकता है। कैल्शियम क्लोराइड के सेवन से hypercalcemia हो सकता है।
FAQ
Q : कैल्शियम क्लोराइड क्या है?
Ans : कैल्शियम क्लोराइड एक अकार्बनिक सफेद रंग का क्रिस्टलीय ठोस पदार्थ होता है, जिसका रासायनिक सूत्र CaCl2 होता है। यह जल में घुलनशील होता है।
Q : कैल्शियम क्लोराइड का रासायनिक सूत्र क्या है ?
Ans : CaCl2
Q : कैल्शियम क्लोराइड का अणुभार कितना होता है ?
Ans : 110.98 ग्राम/मोल
Q : कैल्शियम क्लोराइड का गलनांक कितना होता है ?
Ans : 772-775 °C anhydrous अणु के लिए
Q : कैल्शियम क्लोराइड का क्वथनांक कितना होता है ?
Ans : 1935 °C anhydrous अणु के लिए
Q : कैल्शियम क्लोराइड का निर्माण कैसे किया जाता है ?
Ans : कैल्शियम क्लोराइड चूना पत्थर से सॉल्वे प्रक्रिया के उप-उत्पाद के रूप में प्राप्त होता है। सॉल्वे प्रक्रिया में चूना पत्थर से कैल्शियम क्लोराइड प्राप्त करने की अभिक्रिया इस प्रकार है।
2NaCl + CaCO3 → Na2CO3 + CaCl2
प्रयोगशाला में कैल्शियम हाइड्रोक्साइड और हाइड्रोक्लोरिक एसिड की अभिक्रिया से भी कैल्शियम क्लोराइड बनाया जा सकता है।
Ca(OH)2 + HCl → CaCl2 + H2O
Q : कैल्शियम क्लोराइड का क्या क्या उपयोग है ?
Ans : कैल्शियम क्लोराइड बर्फ के गठन को रोकने के लिए और डीलिंग में किया जाता है। यह सक्रिय चारकोल के उत्पादन में में काम आता है। यह नर पशुओं के लिए एक जीवाणुनाशक के रूप में प्रयोग किया जाता है। बियर बनाने में खनिज की कमी को दूर करने के लिए इसका उपयोग किया जाता है। यह हीटिंग पैड और सेल्फ-हीटिंग कैन में काम आता है। स्पोर्ट्स ड्रिंक में कैल्शियम क्लोराइड का उपयोग इलेक्ट्रोलाइट के रूप में किया जाता है।
Read also
- कैल्शियम हाइड्रॉक्साइड क्या है ? इसके सूत्र, गुण, संरचना, उपयोग और बनाने की विधि
- कैल्शियम कार्बोनेट क्या होता है ? CaCo3 के गुण,संरचना,उपयोग और बनाने की विधि
- सोडियम सल्फेट क्या है ? Sodium sulfate बनाने की विधि और उपयोग,गुण, संरचना
- Potassium sulphate : पोटेशियम सल्फेट का उत्पादन व उपयोग
- हाइड्रोक्लोरिक एसिड क्या है ? HCl के गुण,संरचना,उपयोग, बनाने की विधि का विवरण
- कपड़े धोने का साबुन बनाने का बिज़नेस कैसे करें ?

मेरा नाम गोविन्द प्रजापत है। मैं talentkiduniya.com का फाउंडर हूँ। मुझे स्कूल के समय से ही हिंदी में लेख लिखने और अपने अनुभव को लोगो से शेयर करने में रूचि रही है। मैं इस ब्लॉग के माध्यम से अपनी नॉलेज को हिंदी में लोगो के साथ शेयर करता हूँ।
