सल्फ्यूरिक एसिड क्या है ? सल्फ्यूरिक अम्ल रसायन विज्ञान का महत्वपूर्ण अकार्बनिक अम्ल है जिसका औद्योगिक रूप से अत्यधिक उपयोग किया जाता है। सल्फ्यूरिक अम्ल का प्राचीन समय से ही प्रचलन रहा है। प्राचीन समय में यह हरे कसीस से प्राप्त किया जाता है। आधुनिक समय में इसके निर्माण की अनेक बेहतरीन तकनिकी है। H2SO4 की संरचना, गुण उपयोग व बनाने की विधि जानने के लिए आपको यह आर्टिकल ध्यान से पढ़ना होगा।
सल्फ्यूरिक एसिड क्या है ? H2SO4 के गुण,संरचना, उपयोग, और बनाने की विधि
सल्फ्युरिक एसिड क्या है ? (sulfuric acid kya hai ?)
सल्फ्युरिक एसिड एक प्रबल अकार्बनिक अम्ल है। जिसे गन्धकाम्ल के नाम से भी जाना जाता है। शुद्ध गन्धकाम्ल रंगहीन, गंधहीन, तेल जैसा गाड़ा तरल पदार्थ होता है। यह जल में पूर्णतया विलेयशील होता है। इसका रासायनिक सूत्र H2SO4 होता है। और अणुभार 98.079 ग्राम/मोल होता है। सांद्र H2SO4 को अम्लराज कहा जाता है। इसका उपयोग प्रयोगशाला में अभिकारक तथा अनेक रासायनिक उद्योगों में विभिन्न रासायनिक पदार्थों के संश्लेषण में होता है। इसका अत्यधिक मात्रा में उत्पादन करने के लिए सम्पर्क विधि का प्रयोग किया जाता है। कहा जाता है कि जिस देश में सल्फ्युरिक एसिड का उपयोग ज्यादा होता है , वह देश ज्यादा धनी होता है। यह किसी देश की औद्योगीकरण का सूचक माना जाता है।
प्राचीन समय का सल्फ्युरिक एसिड-(sulfuric acid kya hai ?)
सोलहवीं सदी में वैलेंटाइन नामक वैज्ञानिक ने हरे कसीस (FeSO4.7H2O) के आसवन से इसे प्राप्त किया था। इसे तैयार करने के लिए गन्धक द्विजारकिक गैस को जल में घोला जाता था। यह तेल जैसा चिपचिपा होता है। इसी वजह से इसे प्राचीन काल में ”आयँल ऑफ विट्रिआँल” के नाम से जाना जाता था। प्राचीनकाल के कीमियागर एवं रसविद् आचार्यों को गन्धकाम्ल के बारे में बहुत समय से पता था। उस समय इसे प्राप्त करने के लिए हरे कसीस को गर्म किया जाता था। बाद में कुछ रसविद् इसे फिटकरी को तेज आग पर गर्म करके प्राप्त करने लगे। हरे कसीस से प्राप्त होने व तेल जैसा होने की वजह से इसे “कसीस का तेल” भी कहा जाता है। हाइड्रोजन, सल्फर तथा ऑक्सीजन तीन तत्वों के परमाणुओं द्वारा सल्फ्युरिक अम्ल के अणु का संश्लेषण किया जाता है। इसमें ऑक्सीजन अणु होनी की वजह से इसे ”आक्सी अम्ल” भी कहा जाता है।
सल्फ्यूरिक एसिड की संरचना
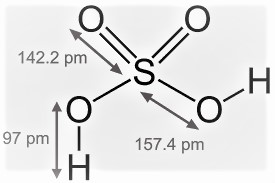
सल्फ्यूरिक एसिड की संरचना चतुष्फलक होती है। इसमें सल्फर का परमाणु केंद्र में होता है जबकि दो ऑक्सीजन के परमाणु और दो हाड्रॉक्सी समूह चतुष्फलक के कोणों पर स्थित होते हैं। इस संरचना में सल्फर व हाड्रॉक्सी समूह के बंध की लम्बाई 157.4 pm तथा सल्फर व ऑक्सीजन के बंध की लम्बाई 142.2 pm होती है। जबकि ऑक्सीजन व हाइड्रोजन परमाणु बंध की लम्बाई 97 pm होती है।
सल्फ्युरिक अम्ल का उपयोग
रसायन विज्ञान में सल्फ्युरिक अम्ल का उपयोग बहुत अधिक किया जाता है। यह हर औद्योगिक इकाई में काम आने वाला अम्ल है। मैं आपको यहाँ कुछ महत्वपूर्ण सल्फ्युरिक अम्ल का उपयोग बता रहा हूँ।
- सल्फ्युरिक अम्ल का उपयोग बैटरी बनाने में (लेड एसिड बैटरी) किया जाता है।
- सल्फ्युरिक अम्ल का उपयोग पेट्रोलियम तथा खनिज तेल के परिष्कार में किया जाता है।
- H2SO4 का उपयोग उर्वरक उद्योग में, जैसे सुपरफास्फेट, अमोनियम सल्फेट आदि के निर्माण में किया जाता है।
- H2SO4 का उपयोग कृत्रिम तंतुओं, जैसे रेयन तथा अन्य सूतों के उत्पादन में भी किया जाता है।
- H2SO4 का उपयोग इनैमल उद्योग में धातुओं पर जस्ता चढ़ाना तथा धातुकर्म उद्योगों में किया जाता है।
- सल्फ्युरिक अम्ल का उपयोग विस्फोटक पदार्थों के निर्माण में किया जाता है।
- गन्धकाम्ल का उपयोग पेंट, वर्णक, रंजक इत्यादि के निर्माण में किया जाता है।
- गन्धकाम्ल का उपयोग ओषधियों के निर्माण में भी किया जाता है।
- इसका प्रयोग फ़ॉस्फ़ोरस, हाइड्रोक्लोरिक अम्ल, नाइट्रिक अम्ल, धावन सोडा तथा अन्य रसायनकों के निर्माण में किया जाता है।
- प्रयोगशालाओं में सल्फ्युरिक अम्ल का प्रयोग विलायकों, निर्जलीकारकों (desiccating agent) तथा विश्लेषिक अभिकर्मकों के रूप में होता है।
- लौहा एवं स्टील, प्लास्टिक तथा अन्य रासायनिक उद्योगों में भी इसका प्रचुर मात्रा में उपयोग किया जाता है।
- सांद्र नाइट्रिक अम्ल और सल्फ्युरिक अम्ल के मिश्रण का उपयोग विस्फोटक के रूप में किया जाता है।
- इसका उपयोग कार्बनिक यौगिकों के निर्माण में किया जाता है।
- सेल्यूलोज नाइट्रेट बनाने में भी H2SO4 का प्रयोग किया जाता है।
सल्फ्युरिक एसिड के भौतिक तथा रासायनिक गुण
सल्फ्यूरिक एसिड के भौतिक तथा रासायनिक गुण निम्नलिखित है –
सल्फ्युरिक अम्ल के भौतिक गुण
- सल्फ्युरिक अम्ल एक प्रबल अम्ल है। इसके अत्यधिक क्रियाशील होने के कारण इसे अम्लों का राजा भी कहा जाता है।
- गन्धकाम्ल का अणुसूत्र H2SO4 होता है और इसका अणुभार 98.079 ग्राम/मोल होता है
- शुद्ध गन्धकाम्ल रंगहीन, गंधहीन, तेल जैसा भारी तरल पदार्थ होता है। तेल जैसा चिपचिपा होने के कारण प्राचीन काल में इसका नाम ‘आयँल ऑफ विट्रिआँल’ रखा गया था।
- यह जल में पूर्णतया घुलनशील होता है।
- शुद्ध अवस्था में 25 डिग्री सेल्सियस ताप पर इसका घनत्व 1.834 है।
- सल्फ्युरिक अम्ल का हिमांक 10.5 डिग्री सेल्सियस होता है।
- आधुनिक विचारधारा के अनुसार H2SO4 अणु की संरचना चतुष्फलक होती है। इसमें H2SO4 का एक परमाणु केंद्र में और दो हाड्रॉक्सी समूह तथा दो ऑक्सीजन के परमाणु चतुष्फलक के कोणों पर स्थित होते हैं। इस अणु संरचना में सल्फर-ऑक्सीजन बंध का अंतर 1.51 एंग्सट्रॉम इकाई होता है।
- सल्फ्युरिक अम्ल का क्वथनांक 337 ° सेल्सियस होता है।
सल्फ्युरिक अम्ल के रासायनिक गुण –
- सल्फ्युरिक अम्ल जल के साथ क्रिया करके अनेक हाइड्रेट बनाता है। जिसमे सल्फ्युरिक मोनोहाइड्रेट अपेक्षाकृत अधिक स्थायी होता है। अपने इस गुण के कारण सांद्र सल्फ्युरिक अम्ल उत्तम शुष्ककारक होता है। यह वायु से जल का अवशोषण करने के साथ कार्बनिक पदार्थों से भी जल का अवशोषण करता है। अतः जल के अवशोषण में अत्यधिक ऊष्मा का क्षेपण होता है। जिसकी वजह से अम्ल का विलयन बहुत गर्म हो जाता है।
- सांद्र सल्फ्युरिक अम्ल प्रबल ऑक्सीकारक होता है। H2SO4 में से ऑक्सीजन परमाणु के निकल जाने पर यह सल्फ्यूरस अम्ल बनता है। जिससे गन्धक द्विजारकिक निकलता है। अनेक धातुओं पर सल्फ्युरिक अम्ल की क्रिया कराने से गन्धक द्विजारकिक प्राप्त होता है।
- सल्फ्युरिक अम्ल का जलीय विलयन में आयनीकरण होता है। जिससे विलयन में हाइड्रोजन धनायन, बाइसल्फ़ेट तथा सल्फ़ेट ऋणायन बनते हैं। अतः रासायनिक विश्लेषण की सामान्य पद्धतियों से सल्फ्युरिक अम्ल में सल्फर, ऑक्सीजन तथा हाइड्रोजन परमाणु की उपस्थिति दर्ज की जाती है।
- 100% शुद्ध गन्धकाम्ल का घनत्व 15° सेल्सियस पर 1.8384 ग्राम प्रति मिलीलीटर होता है। गन्धकाम्ल को गर्म करने पर उससे सल्फर ट्राइऑक्साइड की गैस निकलने लगती है। H2SO4 का 290° सेल्सियस से क्वथन शुरू होता है और यह तब तक होता है जब तक तापमान 317° सेल्सियस नहीं पहुँच जाता। इस ताप पर गन्धकाम्ल 98.54 % रह जाता है। उच्च ताप पर गन्धकाम्ल का विघटन शुरु हो जाता है और जैसे जैसे तापमान बढ़ाया जाता है विघटन बढ़ता जाता है।
- सांद्र सल्फ्युरिक अम्ल जल के साथ क्रिया करके गन्धकाम्ल का मोनोहाइड्रेट,डाइहाइड्रेट,टेट्राहाइड्रेट बनता है जिसका गलनांक क्रमशः 8.47° सेल्सियस, – 39.46° सेल्सियस, गलनांक – 28.25° सेल्सियस होता है। प्रति ग्राम सांद्र H2SO4 व जल क्रिया से 205 कैलोरी उष्मा का उत्पादन होता है।
- सांद्र H2SO4 कार्बनिक पदार्थों, लकड़ी तथा प्राणियों के ऊतकों से जल का अवशोषण कर लेता है। अतः कार्बनिक पदार्थों का विघटन होने से अवशेष के रूप में कोयला रह जाता है। इसी वजह से शरीर व किसी जीव पर H2SO4 के गिरने से वह जल जाता है।
- सल्फ्युरिक अम्ल लवण बनाता है जिसे सल्फ़ेट कहते हैं। यह सल्फ़ेट सामान्य लवण या उदासीन लवण होते हैं। सामान्य लवण सोडियम सल्फ़ेट (Na2SO4) और अम्लीय लवण सोडियम बाइसल्फ़ेट (NaHSO4) इसके उदाहरण है। सोडियम बाइसल्फ़ेट में एक हाइड्रोजन परमाणु है जो अभी क्षारकों से प्रतिस्थापित हो सकता है।
- धातुओं, धातुओं के ऑक्साइड, हाइडॉक्साइड, कार्बोनेट या अन्य लवणों पर H2SO4 की क्रिया से सल्फ़ेट प्राप्त होते हैं। अधिकांश सल्फेट जल में घुलनशील होते है। कैल्सियम, बेरियम, स्ट्रौंशियम और लेड के लवण जल में अविलेय या बहुत कम विलयशील होते हैं। इसमें से ज्यादातर लवण औद्योगिक रूप से महत्वपूर्ण होते है। बेरियम और लेड सल्फ़ेट वर्णक के रूप में काम आता है। सोडियम सल्फ़ेट कागज निर्माण में कॉपर सल्फ़ेट कीटनाशक के रूप में और कैल्सियम सल्फ़ेट प्लास्टर ऑफ पैरिस के रूप में काम आते है।
- लेड और इस्पात पर H2SO4 की कोई अभिक्रिया नहीं होती है।अत: H2SO4 के निर्माण में तथा सल्फ्युरिक अम्ल को रखने के लिए लेड तथा इस्पात के पात्र काम में लिए जाते है।
सल्फ्युरिक अम्ल बनाने की विधि
सल्फ्युरिक अम्ल बनाने की दो विधि है। पहला प्रयोगशाला विधि और दूसरा औद्योगिक विधि। प्रयोगशाला विधि में H2SO4 की कम मात्रा का ही उत्पादन किया जा सकता है। जबकि औद्योगिक विधि में इसका अत्यधिक मात्रा में उत्पादन किया जाता है।
1. सल्फ्युरिक एसिड बनाने की प्रयोगशाला विधि
प्रयोगशाला में सल्फ्युरिक अम्ल का तीन प्रकार से कम मात्रा में बनाया जा सकता है
1. हाइड्रोजन परॉक्साइड तथा सल्फर डाइऑक्साइड की सीधी अभिक्रिया कराने से H2SO4 का निर्माण होता है।
H2O2 + SO2 → H2SO4
2. सल्फर ट्राइऑक्साइड को जल में मिलाने से H2SO4 का निर्माण होता है।
2SO2 + O2 → 2SO3
SO3 + H2O → H2SO4
3. वायु के संसर्ग में सल्फ़्यूरस अम्ल के विलयन के मंद ऑक्सीकरण से भी सल्फ्युरिक अम्ल का निर्माण किया जा सकता है पर आजकल इस विधि का उपयोग बहुत कम किया जाता है।
2. सल्फ्यूरिक एसिड का औद्योगिक निर्माण की विधि
औद्योगिक प्रक्रिया में H2SO4 का निर्माण दो तरह से किया जाता है। सीस-कक्ष-विधि (lead chamber process) तथा संस्पर्श विधि (contact process) से H2SO4 का उत्पादन किया जाता है।
1. सल्फ्यूरिक एसिड निर्माण की सीस-कक्ष-विधि (lead chamber process)
इस विधि के द्वारा भारी मात्रा में H2SO4 का निर्माण किया जाता है परन्तु इसमें कुछ कमियाँ होने के कारण इसकी जगह संस्पर्श विधि का उपयोग किया जाता है। इस प्रक्रम में नाइट्रिक अम्ल द्वारा सल्फर डाइऑक्साइड का ऑक्सीकरण जल की उपस्थिति में किया जाता है। अतः यह अभिक्रिया बड़े बड़े सीस कक्षों (लेड चैम्बर्स) में कराई जाती है जिसकी वजह से इसका नाम ”सीस-कक्ष-विधि” पड़ा।
सन्न 1740 ई. में लंदन के पास रिचमंड में वार्ड नामक वैज्ञानिक ने सल्फ्यूरिक अम्ल के अत्यधिक उत्पादन के लिए फैक्ट्री डाली। सल्फ्यूरिक अम्ल के निर्माण के लिए सल्फर तथा शोरे के मिश्रण को लोहे के पात्र में गर्म किया जाता था। अम्ल की वाष्प को जल से भरे हुए काँच के पात्रों में एकत्रित किया जाता था। यहाँ प्राप्त अम्ल तनु अम्ल होता है , इसे बाद में बालु ऊष्मक के ऊपर काँच के पात्रों में सांद्र किया जाता था। पर जिन काँच के पत्रों का प्रयोग किया जाता था, वे गर्म होकर टूट जाते थे। कुछ समय बाद इनकी जगह छह फुट चौड़े सीस कक्षों का प्रयोग होने लगा।
सन्न 1810 ई. में होल्केर नामक वैज्ञानिक के कठोर परिश्रम द्वारा आधुनिक सीसकक्ष विधि का प्रयोग शुरू हुआ। सन्न 1818 ई. से सल्फर द्विजारकिक की प्राप्ति के लिए कच्चे माल सल्फर के स्थान पर पाइराइटीज़ नामक खनिज का प्रयोग होने लगा। सन्न 1827 ई. में गे-लुपैक स्तंभ तथा 1859 ई. में ग्लोबर स्तंभ के विकास से सीस-कक्ष-विधि का आधुनिकीकरण शुरू हुआ। अब नाइट्रोजन के ऑक्साइड, गन्धक द्विजारकिक तथा वायु को कक्ष में प्रवेश कराया जाता है। इस गैस मिश्रण को 25 फुट ऊँचे ग्लोवर स्तंभ में नीचे से प्रवेश कराया जाता है। इस स्तंभ में ऊपर से गे-लुसैक स्तंभ का गन्धकाम्ल तथा नाइट्रोसिल गन्धकाम्ल का मिश्रण टपकता है। स्तंभ से निकलने के बाद यह गैस मिश्रण सीस कक्ष में प्रवेश करती है।
1. S + O2 → SO2
OR 4FeS + O2 → 2Fe2O + SO2
2. SO2 + O2 + NO2 → 2SO3
3. SO3 + H2O → H2SO4
सामान्यतया सीस कक्ष तीन प्रकार के होते है। अतः यहाँ कक्ष में वाष्प भी प्रवेश करती है। गैस मिश्रण और वाष्प अभिक्रिया करके सल्फ्यूरिक अम्ल बनाते है। जो सीस कक्ष के तल में एकत्रित होती है। इसके बाद अवशिष्ट गैसे गे-लुसैक स्तंभ में प्रवेश करती हैं। जहाँ मुख्य रूप से नाइट्रोजन के ऑक्साइड उपस्थित रहते है। गे-लुसैक स्तंभ कोक या पत्थर के टुकड़ों से भरा रहता है। यहाँ ऊपर से सल्फ्यूरिक अम्ल टपकता है और अवरोध के कारण धीरे-धीरे गिरकर नाइट्रोजन के ऑक्साइडों को अवशोषित कर लेता है। और नाइट्रोसिल सल्फ्यूरिक अम्ल बनाता है
इससे नाइट्रोजन के ऑक्साइड की हानि होने से बच जाते है। परन्तु सीस कक्ष से प्राप्त सल्फ्यूरिक अम्ल अशुद्ध होता है।अशुद्ध H2SO4 में आर्सोनिक, नाइट्रोजन के ऑक्साइड तथा कुछ लवण होते हैं। इस प्रकार का अम्ल सामान्यतया उर्वरक के निर्माण के लिए काम में लिया जाता है। उर्वरक के निर्माण के लिए शुद्ध अम्ल की आवश्यकता नहीं होती है।
2. सल्फ्यूरिक एसिड निर्माण की संस्पर्श विधि (contact process)
सन्न 1889-90 ई. में नाइट्ज नामक वैज्ञानिक ने संस्पर्श विधि का विकाश किया था। यह सल्फ्यूरिक अम्ल के निर्माण की दूसरी सबसे ज्यादा उपयोग की जाने वाली विधि है। इस प्रक्रिया से प्राप्त अम्ल अधिक शुद्ध और सांद्र होता है। इस प्रक्रिया से किसी भी सांद्रता का अम्ल प्राप्त किया जा सकता है। इस प्रक्रिया द्वारा अम्ल बनाने के लिए गंधक को जलाकर या पाइराइटीज़ को त्तप्त कर गन्धक द्विजारकिक प्राप्त किया जाता है। गन्धक द्विजारकिक को वायु के साथ मिलाकर उत्प्रेरक पर ले लाया जाता है। फिर गन्धक द्विजारकिक वायु में उपस्थित ऑक्सीजन से क्रिया करके सल्फर ट्राइऑक्साइड बनता है। सल्फर ट्राइऑक्साइड को सांद्र गन्धकाम्ल में अवशोषित कराने ओलियम का निर्माण होता है। आगे चलकर इसी ओलियम की जल से क्रिया कराकर इच्छित सांद्रता का अम्ल प्राप्त किया जाता है।
इस प्रक्रिया में प्लैटिनम के सूक्ष्म भागो को उत्प्रेरक के रूप में काम में लिए जाते है। परन्तु प्लैटिनम के महंगे होने की वजह से इसकी जगह पर वैनेडियम पेंटॉक्साइड को उत्प्रेरक के रूप में काम लिया जाता है। यह प्लैटिनम से सस्ता होता है। सल्फर डाइऑक्साइड को आर्सेनिक, राख तथा धूल कणों से बिल्कुल मुक्त रखा जाता है। ताकि उत्प्रेरक की क्रियाशीलता कम न हो। यदि सल्फर डाइऑक्साइड गैस को शुद्ध नही किया जाए तो उत्प्रेरक की क्रियाशीलता जल्द नष्ट हो जाएगी है। अतः गन्धक द्विजारकिक को ऐसे पदार्थों से पारित किया जाता है जहाँ से आर्सेनिक पूर्णतया निकल जाए। जिस कक्ष में उत्प्रेरक होता है उस कक्ष में केवल गन्धक द्विजारकिक, ऑक्सीजन और नाइट्रोजन रहते हैं।
1. S + O2 → SO2
OR FeS2 + O2 → Fe2O3 + SO2
2. NaNO2 + H2SO4 → NaHSO4 + HNO3
3 . HNO3 + SO2 → H2SO4 + 2NO2
उत्प्रेरक कक्ष से निकलती हुई गैस को सांद्र गन्धकाम्ल में अवशोषित किया जाता है। जिससे ओलियम का निर्माण होता है। ओलियम में सल्फ्यूरिक अम्ल के अलावा 40 % से अधिक सल्फर ट्राइऑक्साइड अवशोषित रह सकता है। आगे इस ओलियम में अपनी इच्छानुसार जल मिलकर इच्छित सांद्रता का अम्ल प्राप्त किया जा सकता है। इस प्रक्रिया से कम खर्च में अधिक शुद्धता का सल्फ्यूरिक अम्ल प्राप्त किया जाता है।
FAQ
Q: सल्फ्यूरिक एसिड का अन्य नाम क्या है ?
Ans: सल्फ्यूरिक एसिड का अन्य नाम ”ऑयल ऑफ विट्रोल” (Oil of vitriol) और गन्धकाम्ल है।
Q: सल्फ्यूरिक एसिड का अणुभार कितना होता है ?
Ans: सल्फ्यूरिक एसिड का अणुभार 98.079 ग्राम/मोल होता है।
Q: सल्फ्यूरिक एसिड का प्राचीन नाम क्या है ?
Ans: सल्फ्यूरिक एसिड का प्राचीन नाम ”कसीस का तेल” है
Q: सांद्र सल्फ्यूरिक एसिड को तनु कैसे करे ?
Ans: सांद्र सल्फ्यूरिक एसिड को तनु करते समय सेफ्टी का पूरा ध्यान रखना होगा। यह एक प्रबल अम्ल है। इसीलिए यह जल से क्रिया करके अत्यधिक ऊष्मा का उत्सर्जन करता है। सांद्र सल्फ्यूरिक एसिड को तनु करते समय एसिड को जल में धीरे धीरे मिलाना चाहिए। न की एसिड में जल मिलाना चाहिए। एसिड में जल मिलाने पर वह छलक कर बाहर आ सकता है जिससे आप जल सकते है।
Q: सल्फ्यूरिक एसिड कहाँ मिलता है ?
Ans: जिस दुकानदार के पास लाइसेंस होगा उसी दुकानदार के पास H2SO4 मिलेगा। सरकार ने इसकी बिक्री पर कठोर नियम बना रखे है।
Q: सल्फ्यूरिक एसिड की रासायनिक संरचना क्या होती है ?
Ans: सल्फ्यूरिक एसिड की संरचना चतुष्फलक होती है। इसमें सल्फर का परमाणु केंद्र में होता है जबकि दो ऑक्सीजन के परमाणु और दो हाड्रॉक्सी समूह चतुष्फलक के कोणों पर स्थित होते हैं। इस संरचना में सल्फर व हाड्रॉक्सी समूह के बंध की लम्बाई 157.4 pm तथा सल्फर व ऑक्सीजन के बंध की लम्बाई 142.2 pm होती है। जबकि ऑक्सीजन व हाइड्रोजन परमाणु बंध की लम्बाई 97 pm होती है।
Q: सल्फ्यूरिक एसिड का रासायनिक सूत्र क्या होता है ?
Ans: H2SO4
Q: सल्फ्यूरिक एसिड क्या होता है ?
Ans: सल्फ्युरिक एसिड एक प्रबल अकार्बनिक अम्ल है। जिसे गन्धकाम्ल के नाम से भी जाना जाता है। शुद्ध गन्धकाम्ल रंगहीन, गंधहीन, तेल जैसा गाड़ा तरल पदार्थ होता है। यह जल में पूर्णतया विलेयशील होता है।
Q: सल्फ्यूरिक एसिड का उपयोग खेती में क्या होता है ?
Ans: सल्फ्यूरिक एसिड खेती के लिए खतरनाक है। इसका उपयोग खेती के लिए नहीं किया जाता है। H2SO4 फसल को नष्ट कर देता है। यह जीव-जंतु व वनस्पति के लिए हानिकारक है।
Q: सल्फ्यूरिक एसिड कैसे बनता है ?
Ans: सल्फ्यूरिक एसिड प्रयोगशाला विधि, सीस कक्ष विधि,संस्पर्श विधि से बनाया जाता है। हाइड्रोजन परॉक्साइड तथा सल्फर डाइऑक्साइड की सीधी क्रिया से भी इसका निर्माण किया जाता है।
Q: सल्फ्यूरिक एसिड का उपयोग क्या है ?
Ans: सल्फ्यूरिक एसिड का उपयोग उर्वरक उद्योग में,कृत्रिम तंतुओं, बैटरी बनाने में,ओषधियों के निर्माण में,लौह एवं स्टील, प्लास्टिक तथा अन्य रासायनिक उद्योगों में, इनैमल उद्योग, धातुओं पर जस्ता चढ़ाना तथा धातुकर्म उद्योगों में, विस्फोटक पदार्थों के निर्माण में,पेंट, वर्णक, रंजक के निर्माण में आदि में किया जाता है।
Q: सल्फ्यूरिक एसिड प्राइस कितनी है ?
Ans: सल्फ्यूरिक एसिड की प्राइस अलग अलग जगह पर अलग अलग होती है। मार्किट में बहुत सस्ते में मिल जाता है। परन्तु प्रयोगशाला वाला सल्फ्यूरिक एसिड थोड़ा कॉस्टली होता है। क्योकि वो शुद्ध होता है।
Q: सल्फ्यूरिक एसिड क्या काम आता है ?
Ans: सल्फ्यूरिक एसिड प्रयोगशाला में अभिकर्मक तथा औद्योगिक क्षेत्र में अनेक उत्पादों के संश्लेषण में किया जाता है। औद्योगिक क्षेत्र इसका अत्यधिक मात्रा में उपयोग किया जाता है। उर्वरक उद्योग में,कृत्रिम तंतुओं, बैटरी बनाने में,आदि में किया जाता है।
Q: सल्फ्यूरिक एसिड को ”कसीस का तेल” क्यों कहा जाता है ?
Ans: यह हरे कसीस को गर्म करने से मिलता है। यह तेल जैसा चिपचिपा व गाड़ा होता है। इसीलिए इसे ”कसीस का तेल”कहा जाता है।
Q: प्राचीन समय में सल्फ्यूरिक एसिड कैसे बनाया जाता था ?
Ans: हरे कसीस (FeSO4.7H2O) को गर्म करने से प्राचीन समय में सल्फ्यूरिक एसिड बनाया जाता था जिसे ”कसीस का तेल” भी कहा जाता है। यह तेल जैसा चिपचिपा व गाड़ा होता है। ”ऑयल ऑफ विट्रोल” भी कहते है।
Q: किस विधि से सबसे अच्छा सल्फ्यूरिक एसिड बनाया जाता है ?
Ans: संपर्क विधि से सबसे अच्छा सांद्र सल्फ्यूरिक एसिड प्राप्त किया जाता है जो की पूर्ण रूप से शुद्ध होता है।
Q: तनु सल्फ्यूरिक एसिड की अभिक्रिया जस्ता (जिंक) से कराने पर क्या होता है ?
Ans: जस्ता (जिंक) की अभिक्रिया तनु सल्फ्यूरिक एसिड से कराने पर लवण तथा हाइड्रोजन गैस के बुलबुले प्राप्त होते है।
Read also
- Toluene : टाल्यूईन बनाने की विधि और इसका उपयोग
- Calcium chloride : कैल्शियम क्लोराइड का उपयोग और बनाने की विधि
- Potassium sulphate : पोटेशियम सल्फेट का उत्पादन व उपयोग
- Ammonium acetate : अमोनियम एसीटेट का उत्पादन और उपयोग, सूत्र, संरचना, गुण
- सोडियम कार्बोनेट क्या है ? Na2CO3 के गुण,संरचना, उपयोग और बनाने की विधि
- Aluminium sulfate : एल्युमीनियम सल्फेट का उत्पादन, उपयोग, गुण, संरचना व सूत्र

मेरा नाम गोविन्द प्रजापत है। मैं talentkiduniya.com का फाउंडर हूँ। मुझे स्कूल के समय से ही हिंदी में लेख लिखने और अपने अनुभव को लोगो से शेयर करने में रूचि रही है। मैं इस ब्लॉग के माध्यम से अपनी नॉलेज को हिंदी में लोगो के साथ शेयर करता हूँ।

Nice information about hydrogen chloride and hydrochloric acid